Este contenido fue hecho con la asistencia de una inteligencia artificial y contó con la revisión del editor/periodista.
Los investigadores describieron el caso en un nuevo estudio, afirmando que es uno de los primeros en ser tratado con éxito con una terapia personalizada que busca corregir un pequeño, pero crucial, error en su código genético.
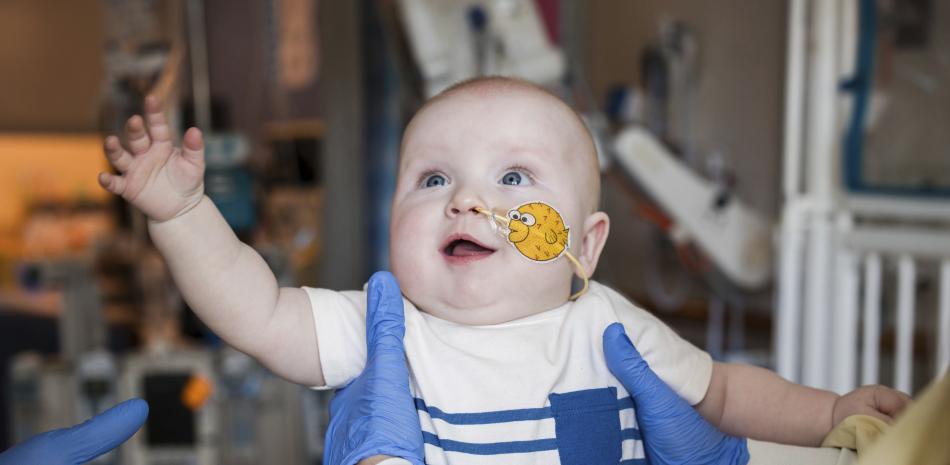
Un bebé nacido con una enfermedad genética inusual y peligrosa está creciendo y desarrollándose después de recibir un tratamiento experimental de edición genética hecho solo para él.
Los investigadores describieron el caso en un nuevo estudio, diciendo que es uno de los primeros en ser tratado con éxito con una terapia personalizada que busca corregir un pequeño, pero crítico, error en su código genético que mata a la mitad de los bebés afectados.
Aunque puede pasar un tiempo antes de que tratamientos personalizados similares estén disponibles para otros, los médicos esperan que la tecnología algún día pueda ayudar a los millones que se han quedado atrás, incluso cuando la medicina genética ha avanzado, debido a que sus condiciones son muy raras.
“Este es el primer paso hacia el uso de terapias de edición genética para tratar una amplia gama de trastornos genéticos raros para los cuales actualmente no hay tratamientos médicos definitivos”, dijo el doctor Kiran Musunuru, experto en edición genética de la Universidad de Pensilvania y coautor del estudio publicado el jueves en el New England Journal of Medicine.
El bebé, KJ Muldoon de Clifton Heights, Pensilvania, es uno de los 350 millones de personas en todo el mundo con enfermedades raras, la mayoría de las cuales son genéticas. Fue diagnosticado poco después de nacer con una deficiencia severa de CPS1, que algunos expertos estiman afecta a aproximadamente uno de cada millón de bebés. Esos bebés carecen de una enzima necesaria para eliminar el amoníaco del cuerpo, evitando que se acumule en la sangre y se vuelva tóxico. Un trasplante de hígado es una opción para algunos.
Conociendo las probabilidades de KJ, sus padres Kyle y Nicole Muldoon, ambos de 34 años, se preocuparon de que podrían perderlo.
“Sopesamos todas las opciones, hicimos todas las preguntas para el trasplante de hígado, que es invasivo, o algo que nunca se había hecho antes”, dijo Nicole.
“Rezamos, hablamos con personas, recopilamos información y finalmente decidimos que este era el camino que íbamos a seguir”, agregó su esposo.
En seis meses, el equipo del Hospital Infantil de Filadelfia y Penn Medicine, junto con sus socios, crearon una terapia diseñada para corregir el gen defectuoso de KJ. Utilizaron CRISPR, la herramienta de edición genética que les dio a sus inventores el Premio Nobel en 2020.
En lugar de cortar la cadena de ADN como los primeros enfoques de CRISPR, los médicos emplearon una técnica que cambia la “letra” de ADN mutada, también conocida como base, al tipo correcto. Conocida como “edición de bases”, esta reduce el riesgo de cambios genéticos no deseados.
Es “muy emocionante” que el equipo haya creado la terapia tan rápidamente, dijo el investigador de terapia génica Senthil Bhoopalan en el Hospital de Investigación Infantil St. Jude en Memphis, quien no participó en el estudio. “Esto realmente marca el ritmo y el estándar para tales enfoques”.
En febrero, KJ recibió su primera infusión intravenosa con la terapia de edición genética, administrada a través de pequeñas gotas de grasa llamadas nanopartículas lipídicas que son absorbidas por las células del hígado.
Aunque la sala estaba llena de emoción ese día, “él durmió durante todo el proceso”, recordó la autora del estudio, la doctora Rebecca Ahrens-Nicklas, experta en terapia génica en el Hospital Infantil de Filadelfia (CHOP).
Después de dosis de seguimiento en marzo y abril, KJ ha podido comer de manera más normal y se ha recuperado bien de enfermedades como resfriados, que pueden poner tensión en el cuerpo y exacerbar los síntomas de CPS1. El niño de nueve meses y medio también toma menos medicamentos.
Considerando su pronóstico anterior, “cada vez que vemos incluso el hito más pequeño, como un pequeño saludo o darse la vuelta, es un gran momento para nosotros”, dijo su madre.
Aún así, los investigadores advierten que solo han pasado unos meses. Tendrán que observarlo durante años.
“Estamos todavía en las primeras etapas de entender lo que este medicamento puede haber hecho por KJ”, dijo Ahrens-Nicklas. “Pero cada día, nos muestra señales de que está creciendo y saliendo adelante”.
Los investigadores esperan que lo que aprendan de KJ ayude a otros pacientes con enfermedades raras.
Las terapias génicas, que pueden ser extremadamente costosas de desarrollar, generalmente se dirigen a trastornos más comunes en parte por razones financieras simples: más pacientes significan potencialmente más ventas, lo que puede ayudar a pagar los costos de desarrollo y generar más ganancias.
La primera terapia CRISPR aprobada por la Administración de Alimentos y Medicamentos de Estados Unidos (FDA), por ejemplo, trata la enfermedad de células falciformes, un trastorno sanguíneo doloroso que afecta a millones en todo el mundo.
Musunuru dijo que el trabajo de su equipo, financiado en parte por los Institutos Nacionales de Salud de Estados Unidos, demostró que crear un tratamiento personalizado no tiene que ser prohibitivamente caro. El costo “no estaba muy lejos” de los más de 800.000 dólares de un trasplante de hígado promedio y el cuidado relacionado, indicó.
“A medida que mejoremos en la creación de estas terapias y acortemos aún más el tiempo, las economías de escala entrarán en juego y esperaría que los costos disminuyan”, dijo Musunuru.
Los científicos tampoco tendrán que rehacer todo el trabajo inicial cada vez que creen una terapia personalizada, dijo Bhoopalan, porque esta investigación “prepara el escenario” para tratar otras condiciones raras.
Carlos Moraes, profesor de neurología en la Universidad de Miami, que no participó en el estudio, opinó que investigaciones como esta abren la puerta a más avances.
“Una vez que alguien llega con un avance como este, no tomará tiempo” para que otros equipos apliquen las lecciones y avancen, dijo. “Hay barreras, pero predigo que se van a cruzar en los próximos cinco a diez años. Entonces, todo el campo avanzará como un bloque porque estamos bastante listos”.