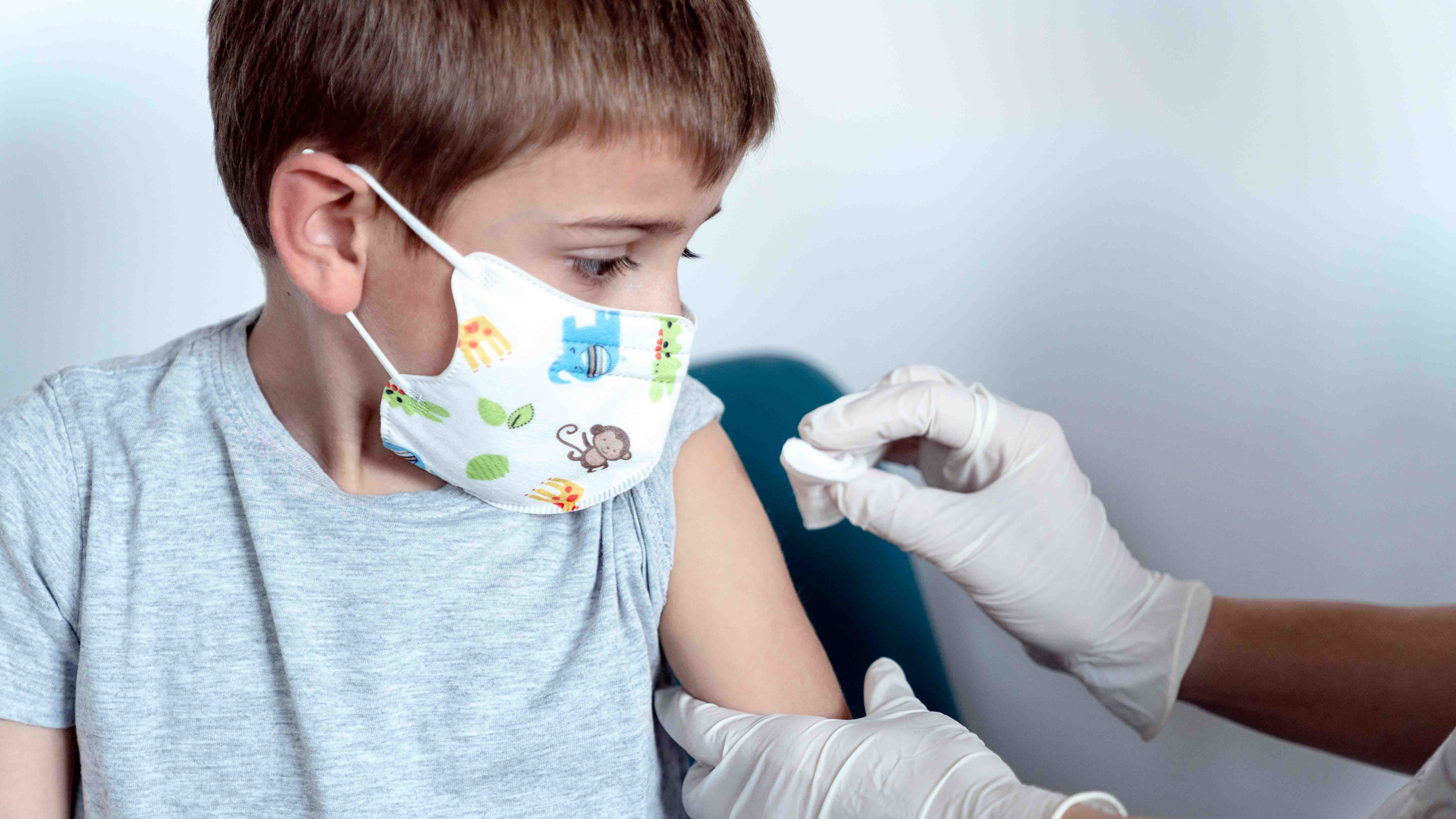
Nueva York – Tres dosis de la vacuna COVID-19 de Pfizer previenen fuertemente a los niños menores de cinco años, según informó la empresa el lunes. Pfizer tiene previsto presentar estos datos a los organismos reguladores estadounidenses a finales de esta semana.
La noticia llega tras meses de angustiosa espera por parte de padres desesperados por vacunar a sus bebés y niños en edad preescolar, especialmente porque los casos de COVID-19 están aumentando de nuevo. Los 18 millones de niños menores de 18 años son el único grupo de EE.UU. que aún no puede vacunarse contra la COVID-19.
La Food and Drug Administration ha empezado a evaluar los datos de su rival Moderna, que espera empezar a ofrecer dos inyecciones para niños antes del verano.
Pfizer ha tenido problemas para encontrar un enfoque. Pfizer pretende ofrecer a los niños dosis tan bajas como una décima parte de la dosis para adultos, pero durante los ensayos descubrió que dos inyecciones no eran suficientes para los niños en edad preescolar. Así que los investigadores administraron una tercera inyección a más de 1.600 niños de entre seis meses y cuatro años durante la oleada invernal de la variante Omicron.
En un comunicado de prensa, Pfizer y su socio Biotech declararon que las inyecciones adicionales tuvieron éxito, aumentando los niveles de anticuerpos de los niños contra el virus lo suficiente como para cumplir los criterios de la FDA para el uso de emergencia de la vacuna sin problemas de seguridad.
Los datos preliminares sugieren que la serie de vacunación de tres dosis tiene una eficacia del 80% en la prevención de la COVID-19 sintomática, afirmaron las empresas, aunque advirtieron que esta estimación se basa en sólo 10 casos diagnosticados entre los participantes en el ensayo a finales de abril. Según las normas del estudio, se necesitan al menos 21 casos para determinar formalmente la eficacia, y Pfizer ha prometido actualizar esta cifra a medida que se disponga de más datos.
Según el Gobierno, cada pedido incluirá ocho pruebas rápidas del antígeno COVID-19 que los estadounidenses podrán utilizar en casa.
Las empresas ya han presentado las dos primeras rondas de datos a la FDA, y la tercera y última se presentará esta semana, según el Dr. Ugur Sahin, director general de BioNTech.
Este estudio sugiere que una vacuna de baja dosis de 3 microgramos, cuidadosamente seleccionada en función de los datos de tolerabilidad, puede proporcionar una alta eficacia profiláctica contra la reciente cepa COVID-19 en niños pequeños”.
¿Y ahora qué?” El Dr. Peter Marks, responsable de vacunas de la FDA, prometió que la evaluación de las vacunas de dosis bajas de Pfizer y Modena “procedería con celeridad sin sacrificar nuestros estándares”.
Los Centros para el Control y la Prevención de Enfermedades (CDC) de EE.UU. recomiendan que, en la medida de lo posible, los viajeros se sometan a las pruebas de COVID-19 antes de viajar.
Los Centros para el Control y la Prevención de Enfermedades (CDC) de EE.UU. han fijado una fecha provisional para que los asesores científicos debatan públicamente los datos de las empresas el mes que viene.
Moderna aspira a ser la primera en vacunar a niños pequeños; los datos presentados a la FDA muestran que los niños adquieren altos niveles de anticuerpos antivirus tras dos inyecciones de una cuarta parte de la dosis para adultos. El estudio de Modena demostró que, durante el refuerzo con Omicon, la eficacia contra la COVID-19 sintomática era del 40-50%, similar a la de los adultos que recibieron sólo dos dosis de la vacuna.
Hasta ahora, la FDA sólo ha aprobado el uso de esta vacuna para adultos. La prueba puede identificar y distinguir simultáneamente entre múltiples virus respiratorios, detectando la gripe A y B, comúnmente conocida como influenza, el virus sincitial respiratorio, comúnmente conocido como VSR, así como el SARS-CoV-2, el virus responsable del COVID-19. La prueba puede utilizarse para detectar el SARS-CoV-2, el virus responsable del COVID-19. Los resultados de la prueba se facilitan a través de un portal en línea, con seguimiento por un profesional sanitario en caso de resultados positivos o no válidos.
Se espera que la FDA revise los datos de Moderna en grupos de edad más jóvenes, además de los estudios en adolescentes y niños de primaria. Otros países ya han ampliado el uso de Moderna a niños de hasta 6 años.
En general, la COVID-19 no es tan peligrosa para los jóvenes como para los adultos, pero algunos niños enferman gravemente o mueren. La variante omicron también afecta especialmente a los niños, con tasas de hospitalización más elevadas entre los menores de cinco años que en el momento álgido de la anterior oleada delta.
Se desconoce el alcance de la demanda de vacunación de los niños más pequeños. Pfizer empezó a vacunar a los niños de 5 a 11 años en noviembre, pero sólo alrededor del 30% de ese grupo de edad recibió las dos dosis iniciales recomendadas. La semana pasada, las autoridades sanitarias estadounidenses señalaron que, para obtener la mejor protección contra la última variante del coronavirus, los niños de primaria deberían recibir una dosis de refuerzo, como se supone que deben hacer todos los niños a partir de 12 años.